lANZADERAS
Las moléculas de NAD+ y NADH no pueden atravesar la membrana mitocondrial interna, que es una barrera selectiva. Por ello el NADH generado durante la glicolisis y por otras deshidrogenasas citosólicas no puede atravesar dicha membrana para llegar a la matriz mitocondrial y dar su par de electrones al complejo I de la cadena transportadora.
Para poder transferir ese " poder reductor " generado en el citosol hasta la cadena transportadora de electrones existen en las células de mamífero dos sistemas de lanzadera de solutos que permiten la transferencia de pares de electrones y protones ( pares de átomos de hidrógeno ) bien directamente hasta la cadena transportadora, bien hasta la matriz mitocondrial.
Estas lanzaderas son dos :
lanzadera glicerol - 3 - P
Este sistema se ha observado en el músculo que mueve las alas para volar en los insectos, que es la máquina biológica con la mayor respuesta de salida conocida; en comparación con su peso es superior al motor de un automóvil pequeño.
A pesar de que la mayoría del NADH se genera a partir de la oxidación de la glucosa en la matriz mitocondrial gracias a las reacciones del ciclo del ácido cítrico, en el citoplasma una pequeña cantidad se obtiene mediante la glucolisis Por tanto, la membrana interna mitocondrial carece de una proteína transportadora de NADH, de ahí que los electrones provenientes del NADH citosólico, son transportados al interior de la mitocondria por un ingenioso sistema de lanzadera. En este sistema o lanzadera del glicerol fosfato, la deshidrogenasa del glicerol-3-fosfato, cataliza la oxidación de NADH citoplásmico por la dihidroxiacetonafosfato para dar NAD+, el cual se reintegra a la glucólisis. Los electrones que resultan del glicerol-3-fosfato se transfieren a una flavoproteína deshidrogenasa para formar FADH2. Esta enzima, la cual se encuentra en cara externa de la membrana interna mitocondrial suple de electrones a la cadena de transporte de electrones en una manera similar a la de la succinato deshidrogenasa. Por lo anterior, la lanzadera de glicerofosfato resulta en la síntesis de 2 moléculas de ATP por cada NADH citoplásmico reoxidizado.


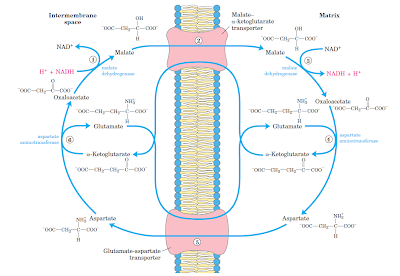
lanzadera malato - aspartato

Este sistema se ha observado en las células de los mamíferos y es más complicado que el sistema de glicerol fosfato de los insectos pero más eficiente desde el punto de vista energético. El NAD+ citoplásmico es reducido a NADH a través de la reducción intermediaria y subsiguiente regeneración de oxaloacetato. Este proceso ocurre en dos fases de tres reacciones cada uno.
FASE I. Trasporte de electrones hacia la matriz
1. El NADH es reoxidado por oxaloacetato citoplásmico a través de la acción de la malato deshidrogenasa citoplásmica.
2. El transportador de malato-a -cetoglutarato transporta el malato formado en el paso 1 hacia la matriz mitocondrial en intercambio con a cetoglutarato.
3. En la matriz mitocondrial. El NADH es regenerado a partir de NAD+ a través de la oxidación del malato a oxaloacetato por la malato deshidrogenasa mitocondrial.
Fase II. Regeneración del oxaloacetato citoplásmico.
4. una transaminasa convierte el oxaloacetato mitocondrial a aspartarto con la conversión concomitante de glutamato en a cetoglutarato.
5. El aspartato es transportado desde la matriz hacia el citoplasma por el acarreador de glutamato-aspartato en intercambio con glutamato citosólico.
6. El aspartato citosólico es convertido a oxaloacetato por una transaminasa con la conversión de a cetoglutarato a glutamato.
Los electrones del NADH citoplásmico son transferidos al NADH mitocondrial, el cual esta sujeto a reoxidaciones vía la cadena de transporte de electrones. La lanzadera demalato-aspartato produce tres moles de ATP por cada NADH citosólico, una más que la lanzadera de glicerol fosfato.
VIAS PENTOSAS FOSFATO
Ruta de degradación con función de biosíntesis: proporciona NADPH y ribosa-5-fosfato para reacciones de biosíntesis, pero también puede degradar glucosa, o pentosas de los nucleótidos procedentes de la hidrólisis de los ácidos nucleicos de la dieta, hasta CO2 y agua. Tiene dos fases:
La fase oxidativa genera por cada molécula de glucosa; 2 moléculas de NADPH, 1molécula de
ribulosa-5-fosfato y una molécula de CO2. Consta de tres reacciones:
- Reacción 1. Oxidación de la glucosa-6-fosfato a 6-fosfogluconolactona (glucosa-6-fosfato deshidrogenasa)
Reacción de la glucosa-6-fosfato deshidrogenasa
Reacción 3. Descarboxilación oxidativa a ribulosa-5-fosfato (6-fosfogluconato deshidrogenasa).
Reacción de la fosfogluconato deshidrogenasa
La oxidación del grupo hidroxilo origina un β-cetoácido que se descarboxila con facilidad
La fase no oxidativa convierte 3 azúcares fosfato de 5 carbonos en 2 azúcares fosfato de 6 carbonos y 1 azúcar fosfato de 3 carbonos
Isomerización y epimerización de la ribulosa 5-fosfato
Las reacciones de la ribulosa 5-
lugar con intervención de
intermediarios enediol. En la reacción
de la isomerasa, una base situada en el
enzima elimina un protón de C1 de
Ru5P a fin de formar un 1,2-enediolato
y después adiciona un protón a C2 para
formar R5P. En la reacción de la
epimerasa, una base situada en el
enzima elimina un protón en C3 para
formar un 2,3-enediolato. A
continuación se añade un protón al
mismo átomo de carbono pero con
inversión de la configuración para
rendir Xu5P 3
Diagrama esquemático simplificado que muestra la
ruta de seis pentosas (5C) a cinco hexosas (6C).
Balance global
3 glucosa 6-P + 6 NADP+ + 3 H2O → 2 fructosa 6-P + gliceraldehído 3-P + 6 NADPH + 6 H+ + 3 CO2
Esquema de las reacciones no oxidativas de la ruta de las pentosas fosfato. Estas reacciones convierten pentosas fosfato de nuevo en hexosas fosfato, permitiendo que continúen las reacciones de oxidación.
Los enzimas transaldolasa y transcetolasa son específicos de esta ruta; los otros enzimas también
actúan en las rutas glucolítica o gluconeogénica. Cada reacción es reversible; las flechas
unidireccionales sólo se utilizan para clarificar la dirección durante la oxidación constante de la
glucosa 6-P.
La rotura de un enlace carbono-carbono deja a
menudo un par de electrones libre o carbanión en uno
de los productos y la fuerte tendencia del carbanión a
formar un nuevo enlace da lugar generalmente a un
intermedio inestable. El anillo de tiazolio de la TPP
estabiliza el intermedio carbanión al proporcionar una
estructura electrofílica (deficiente en electrones) en la
que los electrones del carbanión pueden deslocalizarse
por resonancia. A las estructuras con estas
propiedades se las llama frecuentemente “sumideros
de electrones”
La transcetolasa utiliza como coenzima al pirofosfato
de tiamina con objeto de estabilizar el carbanión
formado en la ruptura del enlace C2-C3 de la Xu5P.
La reacción ocurre con los siguientes pasos:
1) Ataque nucleofílico del radical TPP al carbono
carbonilito y posterior protonación.
2) desprotonación de C3 y rotura del enlace C2-C3,
que da como productos G3P y el enzima unido a 2-
(1,2-dihdroxietil)-TPP, que es un carbanión
estabilizado por resonancia.
3) El carbanión C2 ataca al carbono aldehído de la
R5P formando un aducto S7P-TPP.
4) Se elimina TPP con producción de S7P.
El centro activo de la aldolasa (clase I), esta formado
por un residuo de lisina para formar una base de
Schiff con el carbono carbonilo, un residuo de cisteina
que acepta un protón del grupo hidroxilo en el C4, que
lo devuelve a un residuo de histidina tras la ruptura
entre C3 y C4
Mecanismo de reacción
base de Schiff con el grupo carbonilo de 7SP.
2) Se forma un carbanión en C3 que es una base de
Schiff estabilizada, en la ruptura aldólica entre C3
y C4 que elimina E4P.
3) El carbanión estabilizado por resonancia unido
al enzima se adiciona al átomo de C carbonilico de
GAP formando F6P ligado al enzima a través de
una base de Schiff.
4) La base de Schiff se hidroliza regenerando el
enzima activo y se libera F6P.
No hay comentarios:
Publicar un comentario